Polaridad
Polypedia > ► Propiedades polímeros > ► Propiedades fisicas
¿Qué es la polaridad de la resina polimérica?
No todos los polímeros se comportan igual cuando se someten a un voltaje y los plásticos se pueden clasificar como «polares» o «no polares» para describir sus variaciones en el comportamiento. Los plásticos polares no tienen un enlace completamente covalente y hay un ligero desequilibrio en la carga electrónica de la molécula. Un ejemplo simple de este tipo de comportamiento sería el de la molécula del agua (H2O). Los dos átomos de hidrógeno están unidos al átomo de oxígeno y la molécula en general no tiene carga. En realidad, los electrones tienden a estar alrededor del átomo de oxígeno más que alrededor de los átomos de hidrógeno y esto le da al oxígeno una carga ligeramente negativa y los átomos de hidrógeno una carga ligeramente positiva. La molécula de agua en general es neutra y no tiene carga, pero el desequilibrio de los electrones crea una molécula «polar». Este «dipolo polar» se mueve en presencia de un campo eléctrico e intentará alinearse con el campo eléctrico de la misma manera que una aguja de la brújula intenta alinearse con el campo magnético de la tierra.
Base de las reacciones químicas
La base de las reacciones químicas es el enlace covalente entre átomos o elementos. Es el intercambio de electrones entre dos átomos. Fue introducido por GN Lewis en el año 1916. Estos enlaces son direccionales y, por lo tanto, adquieren una forma definida. Hay dos tipos de enlaces covalentes. Los enlaces químicos existen como enlaces covalentes polares y enlaces covalentes no polares. Un polímero se considera polar si su carga se puede medir como positiva o negativa. Si un polímero no tiene carga, decimos que es no polar.
- Algunos ejemplos de plásticos polares son PA, PC, PMMA y ABS
- Los plásticos no polares más comunes son PP, PE, SEBS, PS y PTFE
Muy pocas propiedades de los ingredientes son más importantes para un formulador que la polaridad, y ningún concepto me ha ayudado más a lo largo de los años a resolver problemas de formulación. La polaridad puede afectar la solubilidad, humectación, dispersabilidad, estabilidad de la formulación y emulsificación. Se define como la distribución desigual de electrones entre átomos en una molécula en la que uno tiene mayor electronegatividad que otro, lo que resulta en un dipolo o estructura "doblada". La polaridad depende de las diferencias de electronegatividad en la molécula y su simetría, y a menudo se puede estimar simplemente estudiando la molécula. Las moléculas polares son típicamente moléculas asimétricas lineales, es decir, moléculas con un solo hidrógeno, un solo OH en un extremo o con un solo nitrógeno en un extremo. Los no polares incluyen la mayoría de los compuestos de carbono y moléculas diatómicas de los mismos átomos.
Polaridad
En cuanto a la polaridad, la presencia de átomos de diferente naturaleza provoca que, en los enlaces covalentes, los electrones se desplacen hacia el átomo más electronegativo, creando así un dipolo. Los polímeros que contienen estos átomos muy electronegativos, como el CI, O, N, F, etc. serán compuestos polares, lo que influye en las propiedades del material. Si la polaridad aumenta, se incrementa la resistencia mecánica, la dureza, la rigidez, la resistencia al calor, la absorción de agua y humedad, la resistencia química, así como la permeabilidad a compuestos polares como el vapor de agua y la adhesividad y la adherencia a los metales. Mientras que el aumento de la polaridad disminuye, por otro lado, la dilatación térmica, el poder de aislamiento eléctrico, la tendencia a acumular cargas electroestáticas y la permeabilidad a moléculas polares (O2, N2). De esta manera es posible distinguir familias tales como las poliolefinas, poliésteres, acetales, halogenados, y otras. La incorporación de grupos laterales polares en la estructura del polímero proporciona resistencia al hinchamiento cuando se sumerge en aceites de hidrocarburos. Estos cauchos "resistentes al aceite" comúnmente incluyen átomos electronegativos de los Grupos 5 a 7 de la tabla periódica. Si bien estos átomos forman enlaces covalentes con el carbono, el par de electrones del enlace se desplaza ligeramente hacia el átomo electronegativo. Esto crea una ligera carga negativa en el átomo electronegativo y una ligera carga positiva en el carbono. La naturaleza dipolar de estos enlaces proporciona resistencia al aceite y otras propiedades que no se encuentran en cauchos que contienen solo átomos de carbono e hidrógeno. Para los polímeros de cadena larga, la resistencia al aceite mejora a medida que aumenta el número de grupos polares. Sin embargo, esto no es un efecto puramente aditivo. La presencia de múltiples enlaces polares puede compensarse parcial o completamente entre sí y reducir o eliminar el momento dipolar. Las moléculas dipolares se orientan en un campo eléctrico. Cuando se aplica un campo eléctrico alterno, la orientación de los dipolos cambia hacia adelante y hacia atrás para seguir el campo eléctrico cambiante. Este movimiento genera calor y un aumento de temperatura. Por lo tanto, los cauchos polares se calientan fácilmente en hornos de microondas. Aumentar el número de sustituyentes polares en un polímero generalmente aumenta la densidad, reduce la permeabilidad del gas y da propiedades inferiores a bajas temperaturas.
Polar
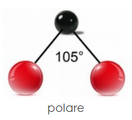 El componente polar es básicamente una medida de electrones libres (o radicales libres) disponibles en la superficie del material para la unión, mientras que el componente dispersivo de la energía superficial (también conocido como fuerzas de dispersión, fuerzas de London o fuerzas de van der Waals) se basa en Fuerzas de nivel atómico que involucran toda la estructura de las moléculas de polímero en la superficie del sustrato. Las fuerzas de dispersión tienden a ser mayores para moléculas más grandes, y la energía superficial de la mayoría de las superficies de polímero sin tratar está determinada principalmente por ellas. A menos que sea un químico físico o de superficie o tenga una formación similar, no son fáciles de visualizar. El componente polar es más intuitivo: un electrón extra (o faltante) está disponible para unirse a un nivel atómico con una superficie con carga opuesta. La fuerza más fuerte y forma enlaces H o enlaces dipolo-dipolo. La diferencia de electronegatividad del átomo es inferior a 0,4. Los enlaces polares tienen un alto punto de fusión, tensión superficial, punto de ebullición y baja presión de vapor. Las moléculas polares interactúan con otras sustancias polares. Estas moléculas tienen cargas positivas y negativas en los extremos opuestos. Por lo tanto, están cargados eléctricamente, Ejemplo: azufre, alcohol, etc.. Los grupos laterales polares (incluidos los que conducen a la formación de puentes de hidrógeno) proporcionan una atracción más fuerte entre las cadenas de polímero, lo que hace que el polímero sea más fuerte.
El componente polar es básicamente una medida de electrones libres (o radicales libres) disponibles en la superficie del material para la unión, mientras que el componente dispersivo de la energía superficial (también conocido como fuerzas de dispersión, fuerzas de London o fuerzas de van der Waals) se basa en Fuerzas de nivel atómico que involucran toda la estructura de las moléculas de polímero en la superficie del sustrato. Las fuerzas de dispersión tienden a ser mayores para moléculas más grandes, y la energía superficial de la mayoría de las superficies de polímero sin tratar está determinada principalmente por ellas. A menos que sea un químico físico o de superficie o tenga una formación similar, no son fáciles de visualizar. El componente polar es más intuitivo: un electrón extra (o faltante) está disponible para unirse a un nivel atómico con una superficie con carga opuesta. La fuerza más fuerte y forma enlaces H o enlaces dipolo-dipolo. La diferencia de electronegatividad del átomo es inferior a 0,4. Los enlaces polares tienen un alto punto de fusión, tensión superficial, punto de ebullición y baja presión de vapor. Las moléculas polares interactúan con otras sustancias polares. Estas moléculas tienen cargas positivas y negativas en los extremos opuestos. Por lo tanto, están cargados eléctricamente, Ejemplo: azufre, alcohol, etc.. Los grupos laterales polares (incluidos los que conducen a la formación de puentes de hidrógeno) proporcionan una atracción más fuerte entre las cadenas de polímero, lo que hace que el polímero sea más fuerte.No polar
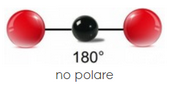 La fuerza más débil y forma interacciones de Van Der Waal entre enlaces no polares. La diferencia de electronegatividad del átomo es superior a 0,4. Los enlaces no polares tienen bajo punto de fusión, tensión superficial, punto de ebullición y alta presión de vapor. Las moléculas no polares no interactúan con otras sustancias no polares. No tiene profusión de cargas en extremos opuestos. Ejemplo: dióxido de carbono, pentano, etc. Los tratamientos de corona, plasma y llama aumentan el componente polar, que es lo que aumenta la energía total de la superficie, proporcionando la mejora en la humectación y la adhesión. El tratamiento de la superficie proporciona dicha polaridad y aumenta el nivel de dina general (que se compone de fuerzas polares y de dispersión) al hacerlo. Por tanto, el cambio en el nivel de dina entre las superficies de polímero tratadas y no tratadas es esencialmente una medida del aumento de polaridad en esa superficie
La fuerza más débil y forma interacciones de Van Der Waal entre enlaces no polares. La diferencia de electronegatividad del átomo es superior a 0,4. Los enlaces no polares tienen bajo punto de fusión, tensión superficial, punto de ebullición y alta presión de vapor. Las moléculas no polares no interactúan con otras sustancias no polares. No tiene profusión de cargas en extremos opuestos. Ejemplo: dióxido de carbono, pentano, etc. Los tratamientos de corona, plasma y llama aumentan el componente polar, que es lo que aumenta la energía total de la superficie, proporcionando la mejora en la humectación y la adhesión. El tratamiento de la superficie proporciona dicha polaridad y aumenta el nivel de dina general (que se compone de fuerzas polares y de dispersión) al hacerlo. Por tanto, el cambio en el nivel de dina entre las superficies de polímero tratadas y no tratadas es esencialmente una medida del aumento de polaridad en esa superficie¿Es predecible la resistencia a los disolventes con polímeros?
Para evaluar la resistencia a los solventes, primero considere los solventes distribuidos en una escala de polaridad. Los disolventes no polares están en un extremo, como la parafina, la gasolina y el diesel. En el otro extremo "altamente polar" encontramos alcoholes y agua. En el medio hay disolventes moderadamente polares como acetona, ésteres y disolventes clorados. En la misma escala de polaridad podemos ubicar las familias de termoplásticos. El polietileno y el poliestireno están en el extremo no polar y las poliamidas en el extremo altamente polar. El PVC, los acrílicos y los poliésteres se encuentran en algún punto intermedio en la región 'moderadamente polar'. Cuando un termoplástico amorfo y un solvente coinciden en la escala, podemos esperar una solubilidad total, dado un poco de tiempo y calor para que el polímero se disuelva finalmente. Sin embargo, los termoplásticos semicristalinos no se disolverán a temperatura ambiente, aunque las regiones amorfas absorberían el disolvente correspondiente y provocarían hinchazón. Si un termoplástico y un solvente no coinciden de manera significativa en la escala, entonces habría poca o ninguna interacción, independientemente de si es amorfa o semicristalina. Esto explica por qué los polímeros de estireno se ven seriamente afectados por los disolventes de hidrocarburos. Por el contrario, el polipropileno y el polietileno, al ser semicristalinos, muestran una resistencia mucho mejor a temperatura ambiente. La escala de polaridad también explica por qué al PVC se le atribuye una "buena resistencia química". Aunque el PVC, un termoplástico amorfo moderadamente polar, puede ser atacado y disuelto en solventes moderadamente polares como el tetrahidrofurano, es resistente a los solventes en ambos extremos de la escala de polaridad: aceite, combustible y agua, que por supuesto son los encontrado todos los días productos químicos.
Solubilidad
Si bien una baja solubilidad es una ventaja para la mayoría de las aplicaciones de polímeros, puede ser un problema cuando desee analizarlos. Utilizados para productos que van desde film transparente, pajitas para beber, bolsas de transporte y envases de alimentos, hasta cajas, cajas y botellas, habitualmente nos beneficiamos de las propiedades de los termoplásticos de origen orgánico como el polietileno y el polipropileno, lo que significa que no son solubles en la mayoría de los disolventes. en condiciones ambientales. Sin embargo, tratar de analizar polímeros que son difíciles de disolver y mantener en solución puede ser complicado, requiriendo que el operador trabaje con solventes peligrosamente calientes, a menudo desagradables y en ocasiones costosos.
Disolución de poliolefinas
El proceso requerido para disolver un polímero depende no solo de su química, sino también de su estructura física. Si bien el principio general de que "lo similar se disuelve como" sigue siendo apropiado, parámetros tales como: polaridad, peso molecular, ramificación, grado de reticulación y cristalinidad, contribuyen a la solubilidad del polímero. Un polímero producido a partir de una olefina simple, denominado en la industria petroquímica como "poliolefina", es químicamente extremadamente inerte. Fabricadas a partir de subproductos de las industrias del petróleo y el gas natural, mediante un proceso de polimerización, las poliolefinas representan más del 47% (11,2 millones de toneladas) del consumo total de Europa Occidental de 24,1 millones de toneladas de plásticos cada año, según el Portal de Plásticos. El polietileno y el polipropileno son dos de las poliolefinas más importantes comercialmente. Escasamente solubles, solo se pueden disolver y mantener en solución mediante la aplicación y el mantenimiento de temperaturas de hasta 160 grados y el uso de solventes que generalmente presentan problemas toxicológicos y / o ambientales importantes. Por tanto, el análisis puede ser un gran desafío.
Plásticos polares y no polares
En los plásticos polares, los dipolos se crean por un desequilibrio en la distribución de electrones y en presencia de un campo eléctrico, los dipolos intentarán moverse para alinearse con el campo. Esto creará una «polarización dipolo» del material y, como el movimiento de los dipolos está involucrado, hay un elemento de tiempo en el movimiento. Ejemplos de plásticos polares son el polimetil-metacrilato (PMMA), el cloruro de polivinilo (PVC), las poliamidas (PA, Nylon), el policarbonato (PC) entre otros, estos materiales tienden a ser moderadamente buenos como aislantes. Los plásticos no polares son verdaderamente covalentes y generalmente tienen moléculas simétricas. En estos materiales no hay dipolos polares presentes y la aplicación de un campo eléctrico no intenta alinear ningún dipolo. Sin embargo, el campo eléctrico mueve los electrones ligeramente en la dirección del campo eléctrico para crear una «polarización electrónica», en este caso el único movimiento es el de los electrones y esto es efectivamente instantáneo. Los ejemplos de plásticos no polares son el politetrafluoro etileno (PTFE, Teflon®) así como otros fluoropolímeros, el polietileno (PE), el polipropileno (PP) y el poliestireno (PS), y estos materiales tienden a tener resistividades altas y constantes dieléctricas bajas. La estructura del polímero determina si es polar o no polar y esto determina muchas de las propiedades dieléctricas del plástico.
| Diferencia entre polar y no polar | |
| POLAR | NO POLAR |
| Asimétrico | Simétrico |
| Tiene postes eléctricos | No tiene postes eléctricos |
| Un extremo de la molécula tiene carga positiva mientras que el otro extremo tiene carga negativa | No tiene profusión de cargas en extremos opuestos |
| Los enlaces H ocurren en enlaces polares | Interacciones de van der waal entre enlaces no polares |
| Al menos un covalente polar está presente en todas las moléculas polares | La covalencia no polar no está presente en todas las moléculas no polares |
| Separación de carga | Sin separación de carga |
| Momento bipolar | Sin momento dipolar |
| Ejemplo: agua | Ejemplo: aceite |
